我校张春林教授团队、汤磊教授团队合作揭示去铁胺(DFO)纳米药物靶向不稳定铁池、抑制多巴胺能神经元铁死亡的神经保护分子机制
来源:
发布时间 : 2024-09-05
点击量:
我校青年教师雷莉主导完成的研究论文“Targeting the Labile Iron Pool with Engineered DFO Nanosheets to Inhibit Ferroptosis for Parkinson's Disease Therapy”,近日发表于材料学国际顶级期刊Advanced Materials(IF:27.4)。该研究设计构建去铁胺(DFO)纳米药物,通过靶向细胞质和线粒体的不稳定铁池 (LIP),减少铁聚集、清除ROS过载,进而抑制多巴胺能神经元铁死亡,改善帕金森病的作用机制研究。
帕金森病(Parkinson disease,PD)是仅次于阿尔茨海默病第二常见的老年性多因素疾病,其核心病理特征是中脑黑质多巴胺能神经元进行性的丢失(死亡),常伴有中脑黑质的铁聚集(Fe离子浓度异常增高)的现象。LIP主要位于细胞质、细胞器的微环境,由与低亲和力配体结合的Fe离子组成,允许铁的摄取、利用、分布和输出。LIP中过度的游离Fe2+通过Fenton反应加剧活性氧(ROS)的形成,导致ROS过载和铁稳态失衡,进而诱导铁死亡。铁死亡是近年来发现并深入研究的铁依赖调节性细胞死亡,被认为是引起PD多巴胺能神经元不可逆退行性丢失的重要途径之一。因此,通过靶向调控LIP稳态是抑制PD多巴胺能神经元铁死亡的重要策略。
基于此,该团队利用黑磷纳米片作为抗氧化剂和载体负载“临床老药”去铁胺(DFO),并共价耦联脑靶向肽RVG29,构建多功能DFO纳米药物(BDPR NSs)。该纳米药物能够螯合游离Fe并抑制铁聚集,从而改善细胞LIP的超负荷、调控铁代谢稳态,并减少ROS产生。此外,BDPR NSs可以聚积在线粒体中,抑制线粒体ROS生成和减少线粒体铁聚集,进而改善线粒体功能障碍。基于受体介导的靶向,BDPR NSs能够有效透过血脑屏障、靶向多巴胺能神经元,在PD病灶区特异性清除ROS和铁聚集,调节铁稳态和降低脂质过氧化,进而抑制铁死亡缓解多巴胺能神经元丢失和运动功能障碍,在PD细胞、线虫及小鼠模型中表现出良好的神经保护作用。总之,该研究表明BDPR NSs具有作为PD临床治疗的新型纳米药物的潜力。
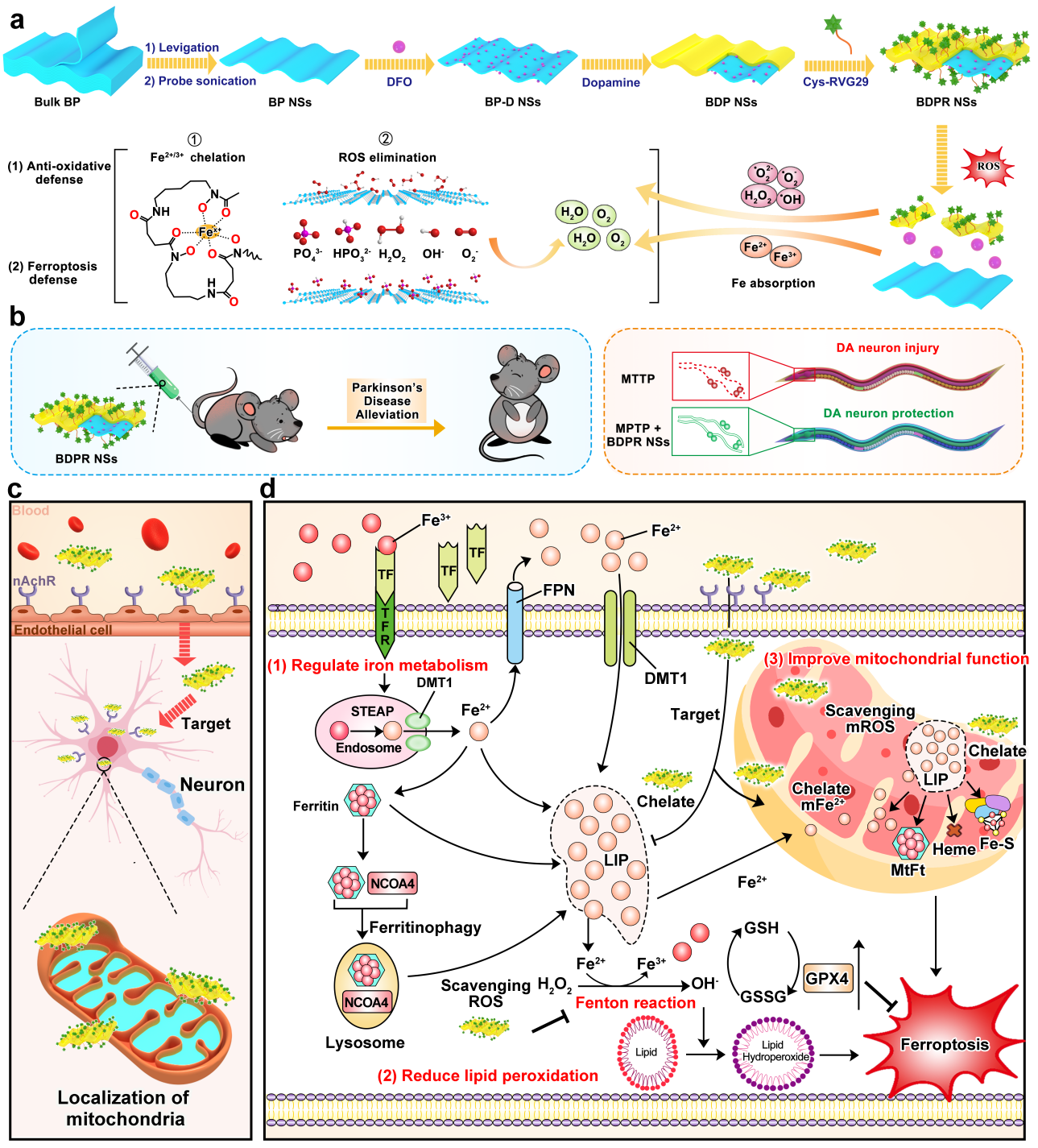
图示:工程化纳米药物BDPR NSs在细胞、线虫和小鼠帕金森病模型中的神经保护作用及机制示意图。
张春林教授和汤磊教授为该文章的共同通讯作者,bat365官网登录入口雷莉副教授、2024届毕业研究生袁佳丽、代志军副教授为文章的并列第一作者。bat365官网登录入口多名师生参与该研究。贵州省医学分子生物学重点实验室、我校分子医学工程研究中心和基础医学科学研究中心提供了仪器和技术支持。该研究受多项国家自然科学基金资助,也是学校近年来围绕“双一流”内涵建设,持续完善创新团队和优秀青年科技人才政策体系的成果之一。
雷莉博士是学校引进的博士青年人才,主要从事靶向递药系统和生物活性载体材料相关科研工作,涉及:研究设计构建系列智能纳米递送体系应用于帕金森病、阿尔兹海默症及恶性肿瘤等疾病诊治的研究;先后承担国家自然科学基金、省科技厅项目及省卫健委项目等;曾在Small、Chemical Science、Analytical Chemistry、Sensors and Actuators B: Chemical以及Journal of Electroanalytical Chemistry等学术期刊上发表7篇研究论文。近3年入职以来,以我校为第一单位在Advanced Materials(1篇);Chemical Engineering Journal(2篇);Nano Convergence(1篇);RSC Advances(1篇)以及中国生物化学与分子生物学报(1篇)等期刊发表多篇文章。


 学院首页
学院首页
 当前位置:
学院首页
>
正文
当前位置:
学院首页
>
正文